集采倒逼醫療器械企業煉內功 做好創新和成本控制
“截至目前,上海市共有58項產品進入國家藥監局醫療器械創新特別審查程序,其中2021年為9項,累計已有22項創新產品取得上市許可。”10月20日,在第二屆醫療器械創新與發展政策研討會現場,上海市藥監局副局長郭術廷表示。

基于高端醫療器械產品研發工作的高投入、高風險等特征,國家出臺了一系列扶持醫療器械產業發展的相關政策。
各方支持下,中國本土創新企業已經成為醫療器械市場不可忽視的重要力量,有跨國企業代表認為,盡管醫療器械市場的競爭對手會越來越多,但也要看到整個中國市場正在不斷變大,很多醫療需求也在被釋放出來。
醫療需求在冠脈支架領域被逐步釋放出來就是一個典型例子。然而,這是在支架生產企業承受集采政策壓力后才意識到的變化。不得不說,集采政策激發了醫療器械企業的創新實力。有醫療器械企業代表表示,集采后企業開始作出調整,成熟產品保證銷量,同時還會大量研發新品,通過增加新品的比重來更好地適應醫改政策。
在康德萊醫械股份董事長梁棟科看來,集采政策下,企業更要修煉內功,做好創新和成本控制。“完全仿制的時代已經過去,醫療器械企業的核心團隊應該來做創新,而創新要來自臨床,貼合臨床。”有現場專家說。
同濟大學上海國際知識產權學院黨委書記宋曉亭就提到,美國的人工智能產品會非常接近臨床。例如,從美國第一件與AI有關的醫療器械“生育信息檢測機器”,到之后的乳房腫瘤早期檢測等。
對于上海的創新醫療器械企業而言,這是發展的黃金時期。上海市的醫械審評審批持續提質增效,對企業上市創新產品釋放了一大積極信號。
郭術廷表示,到2021年底,實現上海市第二類醫療器械首次注冊、許可事項變更、延續注冊的技術審評時限比法定時限平均縮減50%,其中,第二類醫療器械首次注冊審評平均耗時將從100個工作日減少到70個工作日,行政審批平均時限從20個工作日減少到10個工作日。到2022年底,上海市第二類醫療器械產品平均注冊周期會縮短至6到7個月。
國家藥監局醫療器械注冊司專員王蘭明在研討會上指出,優化科學高效的審評審批程序應明確免于提交臨床評價資料的情形。例如對于免于進行臨床評價的,可以免于提交臨床評價資料。
此外,宋曉亭認為,“嚴格的市場法律法規”和“知識產權氛圍與保護”是全球醫療器械產業發展的關鍵因素,而影響醫療器械市場發展的關鍵基本因素又有競爭市場的范圍、現有技術的認定和市場的自由度。
在分析醫療器械領域的特殊之處時,宋曉亭表示,醫療器械需要經過臨床研究、專家評議、藥監審查等程序,可能導致多年的研發和大量的資金投入。醫療器械領域的研發生產成本往往低于高新技術領域,因而專利是其核心因素,用以防止他人模仿,阻止競爭對手參與本產品的市場競爭。他認為,患者的患病經歷、體驗、經驗包含一定的市場價值,可以通過大數據的提煉和總結成就有療效的醫療產品。
當前,為保持競爭優勢,創新械企科學分析產品全生命周期每一階段中的知識產權問題就顯得十分關鍵。宋曉亭提到,例如在設計階段,做好保密和預備申請專利;模型階段,實現樣機模型和有關信息的保密;臨床前和臨床階段,申請適合的專利;在生產階段,對相關內容進行版權保護;在市場階段,對產品和知識產權進行評估。
在經過研討會現場的不同觀點碰撞后,多數企業都表示會選擇大膽地擁抱變化,并持續創新。(顧瑩)
責任編輯:hnmd003
相關閱讀
相關閱讀
-
集采倒逼醫療器械企業煉內功 做好創新和成本控制
截至目前,上海市共有58項產品進入國家藥監局醫療器械創新特別審查程序,其中2021年為9項,累計已有22項...
-
華晨集團“裁員”真相:日后不做實質生產,也不會被完全收購
華晨集團日后不做實質生產,也不會被完全收購,或將做一些對外持股的盈利性工作,一位接近華晨集團人士...
-
紫鑫藥業連續三年業績下滑 國藥兆祥成控股股東
業績持續虧損之下,有人參之王之稱的紫鑫藥業(002118)要易主了。10月20日晚間,紫鑫藥業發布公告稱,公...
-
上海發布第二批虛假違法廣告典型案例 宜家、絲芙蘭等公司被罰
窗簾能凈化空氣?化妝品使用幾天效果明顯?因在廣告中夸大功能、虛構事實,宜家、絲芙蘭等公司遭點名。10...
-
特斯拉第三季度營收再創新高
特斯拉第三季度營收再創新高蓋世汽車訊 在中國工廠擴產的推動下,特斯拉比其它競爭對手更好地抵御了新...
-
“中國汽車工業科學技術獎”揭曉 長城炮榮獲科技進步獎
“中國汽車工業科學技術獎”揭曉 長城炮榮獲科技進步獎10月19日,2021年度“中國汽車工業科學技術獎”...
-
前三季度北京GDP增長10.7% 戰略性新興產業等增長亮眼
3 3倍、1 4倍、1 1倍,打開北京前三季度的成績單,醫藥制造業、高技術制造業、戰略性新興產業的增長...
-
特色小鎮糾偏 嚴防房地產化傾向
借小鎮之名發展房地產項目、長期停留在紙面規劃、觸碰生態紅線……特色小鎮概念興起以來,一批小而美的...
-
股票連續3日漲停 *ST廣珠提示資產重組有風險
自*ST廣珠(600382)15日晚間公告籌劃重大資產重組推進解決資金占用問題后,公司股票已連續3個交易日漲停...
-
煤炭板塊因限價陷入深度調整 電力板塊個股掀漲停潮
20日,A股幾大股指震蕩收跌,量能環比略有放大,板塊分化依舊十分明顯。煤炭板塊因限價而陷入深度調整,...
-
10月貸款市場報價利率繼續按兵不動 LPR連續18個月不變
與市場預期保持一致,10月貸款市場報價利率(LPR)繼續按兵不動。10月20日,央行授權全國銀行間同業拆借中...
-
大眾最大工廠產量跌至1958年以來最低
大眾最大工廠產量跌至1958年以來最低大眾此前表示,由于芯片供應不足,該集團今年的產量缺口將高達數十...
-
萬能險醞釀專項新規 開啟漏洞修補模式
喧鬧過后歸于平靜。近幾年,曾風光無兩的萬能險開啟了漏洞修補模式。繼此前收益率限高等收緊政策接連出...
-
多家公司放棄并購白酒資產 警惕上市公司蹭熱點收購
白酒資產大熱的時候,上市公司掀起一陣跨界買醉的熱潮,現如今,白酒在二級市場的炒作熱情退潮,部分公...
-
保時捷對旗下首款電動車Taycan 在北美市場發起召回行動
因為燈光故障,保時捷對旗下首款電動車Taycan,在北美市場發起了召回行動。據報道,保時捷將召回在美國...
-
愛立信在華業績持續下滑 短期內或難以得到改善
愛立信在中國市場的業績繼續下滑。10月20日,根據愛立信公布的財報,今年三季度該公司整體銷售額同比下...
-
兩億人涌入李佳琦薇婭直播間 “雙11”薅了誰的羊毛
10月20日晚,8點一過,兩億人涌入李佳琦和薇婭直播間。無數屏幕后的拇指開始飛速點擊手機,觀眾被集體消...
-
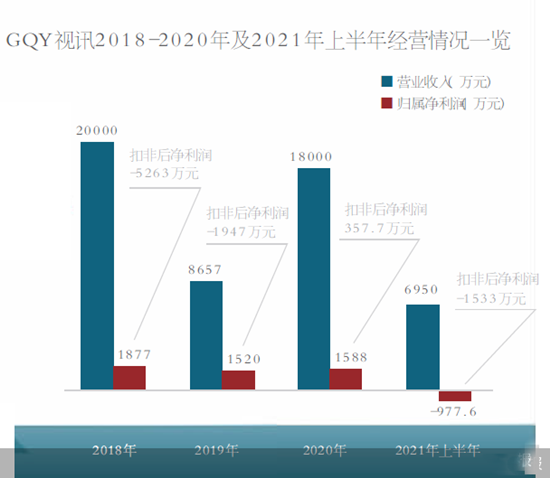
GQY視訊重組四連敗 公司扣非后凈利潤五年四虧
籌劃逾半年,GQY視訊(300076)近日披露終止重組公告,決定終止收購東莞市長隆通信技術有限公司(以下簡稱...
-
恒瑞醫藥三季度營收凈利雙降 研發費用創歷史新高
恒瑞醫藥(600276)20日公布三季報,前三季度實現凈利潤42 07億元,同比下降1 21%,公司在三季度更是出...
-
東財三季報率先報喜 券商板塊后續行情可期
20日又有兩家券商發布業績快報。方正證券披露前三季度營業收入64 59億元,國元證券位居其后,營業收入...
-
9月蔚來和小鵬突破“月銷萬輛”關口,蔚小理要贏特斯拉還有多大差距?
9月,蔚來和小鵬雙雙突破月銷萬輛的關口。北京某蔚來直營店銷售徐宇一邊給店里的展車貼上此車已售的標簽...
-
新能源產業“內卷化”嚴重,“合創”能否和過往切割?
新能源產業的內卷化,已經成為中國車市迭代下愈演愈烈的行業現狀。在這場無盡的競爭風波,傳統車企被逼...
-
售價溢4倍無統一標準,母嬰水是不是智商稅?
一直為母嬰水品牌做代工的廠商負責人劉女士突然想放棄了。母嬰水利潤遠高于普通飲用包裝水,不想代工了...
-
猿輔導賣羽絨服引熱議 業務版圖擴張意欲何為
在線教育機構的業務范圍越來越野了。10月20日,猿輔導要賣羽絨服的消息在網上傳播開來。對此,猿輔導的...
-
飯圈淘寶Owhat“停更” 商家申請退款遭推諉
有著飯圈淘寶之稱的Owhat平臺,在過去很長一段時間里與粉絲的關系都親密無間。然而近期,該平臺一紙無限...
-
南方要比北方冷了?南方多地氣溫將再創立秋后新低
近日,冷空氣持續影響我國。繼北方多地提前感受冬天的寒冷之后,20日起三天,南方部分地區也將在超級濕...
-
房地產調控政策持續加碼 新房價格止漲轉跌
金九銀十往往是樓市的銷售旺季,不過近期房地產調控政策持續加碼,樓市頗有入冬之勢。10月20日,國家統...
-
候鳥遷徙迎高峰期 珍稀鳥類飛來膠州灣海洋公園
當下正是候鳥遷徙高峰,中國稀有鳥類中華鳳頭燕鷗在青島市膠州灣海洋公園紅島段一處漁港現身。近年來,...
-
中國經濟仍處良好恢復態勢 全年經濟走勢或“前高后低”
在嚴峻復雜的國內外環境下,今年前三季度,中國經濟同比增長9 8%,兩年平均增長5 2%。其中,三季度同...
-
高合HiPhi X亮相2021“新四跨”;助推車路協同商業化落地
高合HiPhi X亮相2021“新四跨”;助推車路協同商業化落地2021年10月19日,2021智能網聯汽車C-V2X“新四...
-
現代汽車集團打造“自動駕駛測試平臺” 引領自動駕駛技術發展
現代汽車集團打造“自動駕駛測試平臺” 引領自動駕駛技術發展- 現代汽車集團宣布將在韓國南陽研發中心...
-
實力領跑 燃動助力 捷達SUV簽約2021成都馬拉松冠名贊助商
實力領跑 燃動助力 捷達SUV簽約2021成都馬拉松冠名贊助商10月20日,2021捷達SUV成都馬拉松新聞發布會...
-
二手房降溫明顯 9月52個城市二手房價格環比下降
10月20日,國家統計局官網發布2021年9月份70個大中城市商品住宅銷售價格變動情況。國家統計局城市司首席...
-
前9月我國5G手機出貨量1.83億部 上市新機型與上年同期持平
10月20日消息,中國信通信院發布2021年9月國內手機市場運行分析報告,報告顯示:2021年1-9月,國內市場...
-
5G用戶規模快速擴大 手機終端連接數已達4.45億戶
今天工信部發布《2021年前三季度通信業經濟運行情況》,數據顯示:移動電話用戶規模穩中有增,5G用戶規...
-
愛康科技股價上演“四天三板” 周二完成回購“首秀”
因股價漲幅異動,愛康科技(002610)在最近五個交易日里四次登上龍虎榜。股價方面,公司四個交易日里股價...
-
交強險多少錢?交強險多久賠付到位可賠付金額是多少?
2021交強險價格表。機動車交通事故責任強制保險是由國家統一制定保險價格標準的。在制定相關價格標準的...
-
金圓股份一月內三購資產加“鋰” 公司暫未受到限電明顯影響
起家于建材的金圓股份(000546 SZ)不斷外延式布局,拓展產業布局。10月12日晚間,金圓股份宣布,全資子...
-
認為shopify是唯一跨境獨立站,那就大錯特錯!
隨著時代科技網絡的進步,電商的出現和壯大顯然已經不足為奇了,尤其是近些年疫情的爆發和持續,影響著...
-
至純科技子公司引大基金等4.2億增資 增資前估值25億增值率超485%
國內濕法設備的主要供應商之一、至純科技(603690 SH)子公司至微半導體(上海)有限公司(以下簡稱至微科技...
-
三六零入圍民營企業發明專利前十強 擬29億投資哪吒汽車
三六零入圍民營企業發明專利前十強近日,2021粵港澳大灣區民營企業科技創新峰會暨民營企業科技成果對接...
-
信用卡能取現嗎?手續費和利息如何計算?信用卡能取會影響征信嗎?
在如今,很多人除了使用信用卡刷卡消費,也會使用信用卡取現,這是信用卡固有的功能,但使用信用卡取現...
-
太陽能推46億擴產鞏固光伏龍頭地位 現金流趨緊有息負債達217億
光伏發電龍頭企業太陽能(000591 SZ)大舉擴產。根據最新公告,太陽能擬在甘肅敦煌、湖北監利等投建光伏...
-
康達新材信披違規引關注 擬定增募資7.5億加碼膠黏劑及新材料項目
康達新材信披違規引關注康達新材信披違規,引來深交所下發監管函。10月19日,深交所監管函顯示,康達新...
-
川渝制定81條跨界河流水系圖 助力科學治理跨界河流
記者從市雙城辦獲悉,近日川渝河長制辦公室聯席會議在我市順利召開。會議聽取了我市智慧河長系統建設情...
-
港股出現強勢反彈 公募基金加速對港股市場布局
在經歷短暫盤整后,港股周二出現反彈,恒生指數回到9月中旬點位。公募基金早已盯上了這一價值洼地,紛紛...
-
寧德時代盤中股價破600元 市值一度超過1.4萬億元
昨日,寧德時代高開后迅速沖高,盤中股價一度突破600元,達到614 98元,再創歷史新高,市值一度超過1 ...
-
年內券商因違規被查情況頻發 投行業務違規情況最多
今年以來,隨著監管的加強,券商因違規被查情況頻發,其中不乏頭部券商,如海通證券。其中,投行業務違...
-
“跨境理財通”正式開賣 多家銀行紛紛爭飲“頭啖湯”
跨境理財通正式開賣,19日,多家銀行紛紛爭飲頭啖湯,實現了首批業務成功落地。據初步統計,上午業務開...
-
會員制倉儲超市成新風口 零售企業爭相入局
會員制倉儲超市的時機來了。10月15日,家樂福中國首家會員店向公眾開放并宣稱,規劃在未來3年內將200家...
-
阿迪達斯國內市場業績下滑,探銳開業布局戶外服飾能否“力挽狂瀾”?
阿迪達斯旗下戶外運動品牌探銳(adidas TERREX)近日在中國的首家旗艦店正式開業,落地于上海市靜安嘉里...
-
“雙11”美妝競賽打響 國際美妝品牌占得線上先機
今年的雙11來得比往年更早,其中美妝品牌一馬當先打響了價格戰。國內外品牌摩拳擦掌,在預熱活動中就已...
-
房地產稅試點將明顯推進 目標指向共同富裕
10月16日出版的第20期《求是》雜志發表重要文章《扎實推動共同富裕》。文章指出,要積極穩妥推進房地產...
-
丹江口30萬噸柑橘銷往各地 產值近6億元
10月18日,丹江口市在習家店鎮柑橘交易市場舉行第八屆庫區情 桔鄉情武當蜜橘外銷發車儀式,數十輛滿載...
-
廈門腫瘤醫院請選擇廣州復大醫院:如何解決如籃球般大的腫瘤?
廈門的陳阿姨最近總感到肚子有點不舒服,到了省城醫院檢查后,發現她的肚子里有一個如籃球一般大的腫瘤...
-
合肥京東方醫院 與你一起傳遞守護力量
每年10月18日,是世界乳腺癌宣傳日。在全球范圍內,乳腺癌發病率自20世紀70年代末開始一直呈上升趨勢。全...
-
富士康欲在歐洲、印度和拉丁美洲生產電動車
富士康欲在歐洲、印度和拉丁美洲生產電動車蓋世汽車訊 據外媒報道,10月20日,中國臺灣科技巨頭富士康...
-
湖北市場主體信心持續恢復 千億級產業銷售開票額增加近三成
同比2019年,納稅市場主體增多;新經濟增長迅猛,千億級產業引領增強;企業稅負降低,稅收產出企穩,稅收...
-
年內湖北稅收收入完成4390.41億元 經濟發展質量持續趨好
10月18日,我省發布前三季度經濟高質量發展稅收指數:108 6,超過基準值(100)8 6,反映出產業轉型升級...
-
武漢再建江海直達物流大通道 “武漢—舟山”散貨運輸航線正式開通
10月19日,全國首制、服務長江中游特定航線的江海直達散貨船江海直達19輪,搭載著1 18萬噸美國進口玉米...
-
肉毒素鑒真環節到:Dysport吉適肉毒素的真偽辨別
顏值時代的到來,令越來越多的求美者開始發現并且勇于追求美,眾多的變美需求自然帶動了醫療美容業的高...
-
農戶創業者申請貸款不需擔保 金融活水助力鄉村振興
以往找不到合適的擔保人或抵押物,無法申請貸款。現在銀行政策放寬了,無需任何擔保,農戶也可以申請信...
-
185筆財務數據不真實 國壽財險恩施中支被罰款15萬元
近日,恩施銀保監分局發布行政處罰決定書,因存在財務數據不真實的違法行為,該局對中國人壽財產保險股...
-
豬肉股大“回血”多只龍頭股漲停 豬企已熬過“至暗時刻”
年內表現低迷的豬肉股突然走強,板塊大漲6%。昨日,新五豐、巨星農牧、天康生物、正邦科技、金新農漲停...
-
愛奇藝迷霧劇場花式插播廣告引吐槽 “限廣告令”為啥限不了視頻平臺
付費VIP才能看的劇,看到第7分03秒就彈出第一個貼片廣告。這也太早了,太著急掙錢了,并且這廣告拖進度...
-
谷歌自研Tensor芯片參數曝光,Tensor芯片能否打贏蘋果A15?
今天凌晨,谷歌正式發布了Pixel 6以及Pixel 6 Pro兩款手機,這兩款手機均搭載谷歌自研的Tensor芯片,...
-
新電商黑馬“麥劃算”強勢來襲 ——Z世代年輕人的電商新領地
2021年10月20日,麥劃算分布式智能社群零售服務電商平臺正式上線,作為國內唯一自帶梯媒、社群與供應鏈...
-
無主動降噪功能、不支持iPhone 6及以下機型,第三代AirPods值得買嗎?
10月20日消息,蘋果剛剛發布的第三代AirPods不支持iPhone 6及更老機型。在AirPods(第三代)的技術規格頁...
-
阿里云宣布推出第四代神龍架構 RDMA能大幅降低網絡通信延遲
北京時間10月20日消息,2021云棲大會上,阿里云宣布推出第四代神龍架構,這是飛天云操作系統新一代虛擬...
-
阿斯頓馬丁:2030年電動車至少占其總銷量的50%
阿斯頓馬丁:2030年電動車至少占其總銷量的50%蓋世汽車訊 據外媒報道,10月19日,英國豪華汽車制造商阿...
-
重磅!雷軍退出小米信用董事長,小米汽車轉入小米香港公司名下
雷軍退出小米信用董事長天眼查App顯示,近日,小米信用管理有限公司發生工商變更,雷軍退出董事長,同時...
-
9月Model 3德國銷量超越奧迪、寶馬與奔馳同級別車型
9月Model 3德國銷量超越奧迪、寶馬與奔馳同級別車型9月德國的汽油車銷量同比下降了41%,柴油車的銷量大跌了54%。
-
特斯拉三季度營收取決于上海工廠和供應鏈成本
特斯拉三季度營收取決于上海工廠和供應鏈成本蓋世汽車訊 據外媒報道,投資者將密切關注特斯拉將于美國...
-
大眾:芯片短缺或在Q4緩解,但持續到2022年
大眾:芯片短缺或在Q4緩解,但持續到2022年蓋世汽車訊 據外媒報道,10月19日,大眾汽車美國分公司首席...
-
全新360極速瀏覽器X上線 系360首款64位瀏覽器
近日,全新的360極速瀏覽器X上線,它也是360首款64位瀏覽器。360極速瀏覽器X保持與Chrome的chromium95內...
-
蘋果新款MacBook Pro發售 拼多多百億補貼火速跟進
在昨日舉行的蘋果2021秋季第二場新品發布會上,新款MacBook Pro、AirPods 3以及全新配色的HomePod mi...
-
谷歌Pixel 6系列起售價3800元 預裝Android 12穩定版操作系統
今天,谷歌正式發布Pixel 6和Pixel 6 Pro兩款新機。二者預裝Android 12穩定版操作系統,是全球首批...
-
整治App開屏信息“關不掉”“亂跳轉” 工信部下架408款拒不整改App
很多用戶在日常使用App時,經常會遇到關不掉亂跳轉的情況。在昨天的國新辦發布會上,針對App整治等熱點...
-
新MacBook Pro劉海屏遭網友吐槽:鼠標指針移過劉海時會被遮擋
在昨日的發布會上,蘋果推出了搭載M1 Pro Max處理器的新一代14 16英寸MacBook Pro,無論是外形還是...
-
柴油8AT熱血燃擎開拔倒計時!福田皮卡國門試駕再啟新征程
柴油8AT熱血燃擎開拔倒計時!福田皮卡國門試駕再啟新征程繼2021丈量邊疆國門試駕“祖國南大門”海南文昌...
-
王騰秀出Redmi Note 11 迭代機型高配版支持120W快充
今天,小米公司Redmi產品總監王騰秀出了新手機——Redmi Note 11,意味著這款新機即將發布。此前博主@...
-
曝格力旗下大松手機獲得3C認證 新機將搭載驍龍870旗艦芯片
早在9月初,就有網友曝光了一款格力旗下大松手機的全新機型入網,其中顯示該機將會是一款搭載驍龍870的...
-
鄭州博大男科醫院正規嗎 打造醫療行業典范品牌
鄭州博大男科醫院正規嗎?很多在鄭州治療前列腺炎的患者都會有疑問,前列腺炎給男性患者帶去了巨大的痛苦...
-
全國第二批電子駕照今日開始申領 推廣應用城市達110個
證件電子化時代,居民呼聲最高的,除了身份證之外,就是駕照了。自今年9月1號開始,國內也開始正式實行...
-
鄭州歐華醫療美容整形李永峰醫生科普——自體脂肪填充存活率這樣提高!
說起自體脂肪填充,不少人會擔心術后的存活率,是否會凹凸不平、假面等等,甚至為了保持飽滿的效果,要...
-
小米今日將發布Redmi智能電視X 2022款 同檔率先普及120Hz高刷新率
10月20日消息,今天小米將發布Redmi智能電視X 2022款,號稱同檔率先普及120Hz高刷新率,打造年輕人的新...
-
谷歌發布Pixel 6和Pixel 6 Pro 設備具有至少5年安全更新保證
今天凌晨,谷歌發布了Pixel 6和Pixel 6 Pro,作為安卓陣營的標桿,新機搭載了自研Tensor處理器,同時...
-
中國IPv6網絡“高速公路”全面建成 14個骨干網直聯點實現互聯互通
近日,在國務院新聞辦舉行的前三季度工業和信息化發展情況新聞發布會上,工業和信息化部新聞發言人、信...
-
小米智能攝像機2云臺版發布 攝像機全新升級400萬像素
10月20日,小米智能攝像機2云臺版開啟預售,原價249元,定金10元可抵30元,首發到手價229元。新品攝像機...
-
10月中國汽車保值率研究:雷克薩斯保值率領先
買新車都喜歡買保值率高的車,因此日系車在國內的銷量近些年一直都是穩步提升。如果買二手車的話,圖的...
-
新能源汽車動力電池退役潮將近 工信部:加快推進動力電池回收利用立法
據報道,10月19日,在國務院新聞辦舉行的前三季度工業和信息化發展情況新聞發布會上,有媒體提問:我國...
-
源自日本的眼鏡JINS睛姿,秋日特惠限時搶
秋意漸濃,又是季節更替的時候,總想著要換點什么?一杯奶茶、一件新衣、一副眼鏡,內心的需求,總是最...
-
奧迪因缺芯延長德國工廠停產時間 多款車型受影響
奧迪因缺芯延長德國工廠停產時間 多款車型受影響蓋世汽車訊據外媒報道,受芯片供應短缺影響,奧迪將延...
-
Stellantis與TheF Charging在歐洲合作搭建充電網絡
Stellantis與TheF Charging在歐洲合作搭建充電網絡雙方將在2025年前在全歐洲超過1 5個地點和200萬個停...
-
本地菜出產量下滑外地蔬菜“霸市” 武漢菜價或迎明顯上漲
經過國慶黃金周假期前后的蔬菜采購高峰,市民吃菜進入了一個平穩期。不過,極目新聞記者多方探訪了解到...
-
湖北長江大保護取得明顯成效 經濟發展含“綠”量更高
10月19日,長江經濟帶省市政協共抓長江生態環境保護 共推長江經濟帶綠色發展研討會在湖北武漢舉行,全...
-
金蝶賬無憂牽手阿里云,打造財稅服務數字化戰斗力
疫情加速云服務滲透傳統行業進程,各行各業紛紛將上云作為企業發展最重要的戰略之一。數字化轉型服務商...
-
武漢氣溫持續創新低 江城明晨氣溫降至8℃
昨日早間,武漢最低氣溫僅10 7℃,再度刷新今年下半年以來的氣溫新低;午間12時升至15 7℃,但隨著午后...
-
茶亭序聯合漢尚華蓮,如何彎道超車茶顏悅色!
導語:隨著消費不斷升級,年輕消費群體對茶飲的需求也在升級,市場上不斷涌現的茶飲品牌使得競爭尤為激...
-
前三季度福特中國在華銷量近46萬輛 林肯品牌表現出色
盡管芯片短缺、新冠疫情等對汽車行業的影響仍在持續,消費者對福特品牌SUV車型和高端轎車的需求仍持續保...
閱讀排行
精彩推送
- 集采倒逼醫療器械企業煉內功 做...
- 華晨集團“裁員”真相:日后不做...
- 紫鑫藥業連續三年業績下滑 國藥...
- 上海發布第二批虛假違法廣告典型...
- 特斯拉第三季度營收再創新高
- “中國汽車工業科學技術獎”揭曉...
- 前三季度北京GDP增長10.7% 戰略...
- 特色小鎮糾偏 嚴防房地產化傾向
- 股票連續3日漲停 *ST廣珠提示資...
- 煤炭板塊因限價陷入深度調整 電...
- 10月貸款市場報價利率繼續按兵不...
- 大眾最大工廠產量跌至1958年以來最低
- 萬能險醞釀專項新規 開啟漏洞修...
- 多家公司放棄并購白酒資產 警惕...
- 保時捷對旗下首款電動車Taycan ...
- 愛立信在華業績持續下滑 短期內...
- 兩億人涌入李佳琦薇婭直播間 “...
- GQY視訊重組四連敗 公司扣非后...
- 恒瑞醫藥三季度營收凈利雙降 研...
- 東財三季報率先報喜 券商板塊后...
- 9月蔚來和小鵬突破“月銷萬輛”...
- 新能源產業“內卷化”嚴重,“合...
- 售價溢4倍無統一標準,母嬰水是...
- 猿輔導賣羽絨服引熱議 業務版圖...
- 飯圈淘寶Owhat“停更” 商家申...
- 南方要比北方冷了?南方多地氣溫...
- 房地產調控政策持續加碼 新房價...
- 候鳥遷徙迎高峰期 珍稀鳥類飛來...
- 中國經濟仍處良好恢復態勢 全年...
- 高合HiPhi X亮相2021“新四跨”...
- 現代汽車集團打造“自動駕駛測試...
- 實力領跑 燃動助力 捷達SUV簽...
- 二手房降溫明顯 9月52個城市二...
- 前9月我國5G手機出貨量1.83億部...
- 5G用戶規模快速擴大 手機終端連...
- 愛康科技股價上演“四天三板” ...
- 交強險多少錢?交強險多久賠付到...
- 金圓股份一月內三購資產加“鋰”...
- 認為shopify是唯一跨境獨立站,...
- 至純科技子公司引大基金等4.2億...
- 三六零入圍民營企業發明專利前十...
- 信用卡能取現嗎?手續費和利息如...
- 太陽能推46億擴產鞏固光伏龍頭地...
- 康達新材信披違規引關注 擬定增...
- 川渝制定81條跨界河流水系圖 助...
- 港股出現強勢反彈 公募基金加速...
- 寧德時代盤中股價破600元 市值...
- 年內券商因違規被查情況頻發 投...
- “跨境理財通”正式開賣 多家銀...
- 會員制倉儲超市成新風口 零售企...
- 阿迪達斯國內市場業績下滑,探銳...
- “雙11”美妝競賽打響 國際美妝...
- 房地產稅試點將明顯推進 目標指...
- 丹江口30萬噸柑橘銷往各地 產值...
- 廈門腫瘤醫院請選擇廣州復大醫院...
- 合肥京東方醫院 與你一起傳遞守...
- 富士康欲在歐洲、印度和拉丁美洲...
- 湖北市場主體信心持續恢復 千億...
- 年內湖北稅收收入完成4390.41億...
- 武漢再建江海直達物流大通道 “...
- 肉毒素鑒真環節到:Dysport吉適...
- 農戶創業者申請貸款不需擔保 金...
- 185筆財務數據不真實 國壽財險...
- 豬肉股大“回血”多只龍頭股漲停...
- 愛奇藝迷霧劇場花式插播廣告引吐...
- 谷歌自研Tensor芯片參數曝光,Te...
- 新電商黑馬“麥劃算”強勢來襲 ...
- 無主動降噪功能、不支持iPhone ...
- 阿里云宣布推出第四代神龍架構 ...
- 阿斯頓馬丁:2030年電動車至少占...
- 重磅!雷軍退出小米信用董事長,...
- 9月Model 3德國銷量超越奧迪、...
- 特斯拉三季度營收取決于上海工廠...
- 大眾:芯片短缺或在Q4緩解,但持...
- 全新360極速瀏覽器X上線 系360...
- 蘋果新款MacBook Pro發售 拼多...
- 谷歌Pixel 6系列起售價3800元 ...
- 整治App開屏信息“關不掉”“亂...
- 新MacBook Pro劉海屏遭網友吐槽...
- 柴油8AT熱血燃擎開拔倒計時!福...
- 王騰秀出Redmi Note 11 迭代...
- 曝格力旗下大松手機獲得3C認證 ...
- 鄭州博大男科醫院正規嗎 打造醫...
- 全國第二批電子駕照今日開始申領...
- 鄭州歐華醫療美容整形李永峰醫生...
- 小米今日將發布Redmi智能電視X ...
- 谷歌發布Pixel 6和Pixel 6 Pr...
- 中國IPv6網絡“高速公路”全面建...
- 小米智能攝像機2云臺版發布 攝...
- 10月中國汽車保值率研究:雷克薩...
- 新能源汽車動力電池退役潮將近 ...
- 源自日本的眼鏡JINS睛姿,秋日特...
- 奧迪因缺芯延長德國工廠停產時間...
- Stellantis與TheF Charging在歐...
- 本地菜出產量下滑外地蔬菜“霸市...
- 湖北長江大保護取得明顯成效 經...
- 金蝶賬無憂牽手阿里云,打造財稅...
- 武漢氣溫持續創新低 江城明晨氣...
- 茶亭序聯合漢尚華蓮,如何彎道超...
- 前三季度福特中國在華銷量近46萬...